(厦门大学环境与生态学院,滨海湿地生态系统教育部重点实验室,福建 厦门 361102)
(Key Laboratory of the Coastal and Wetland Ecosystems,Ministry of Education,College of the Environment & Ecology,Xiamen University,Xiamen 361102,China)
DOI: 10.6043/j.issn.0438-0479.202010006
备注
引言
红树林生态系统具有净化水源、蓄洪抗旱、调节小气候的作用[1-2],被称为防风固堤的卫士[3-5],为鸟类、海洋动物、微生物等提供了良好的营养环境与繁殖场所[6].红树林还具有巨大的经济价值,在许多发展中国家,依赖于红树林的小型水产养殖业以及旅游业都为生活在海边的居民带来不菲的经济收入[7-9]; 此外,红树林生态系统中还有巨大的碳储汇[10].
然而,全球气候变化以及人类活动的干扰给滨海湿地生态系统造成了严重的影响,特别是海平面上升和人为砍伐使得在热带、亚热带滨海湿地生存的红树种群数量逐年减少,部分物种甚至处于灭绝的险境[11-16].最新研究显示,红树林移动的速度不足以逃脱海平面上升的影响,到2050年可能会消失[17].人类对土地的过渡使用与富营养化使得红树林遭受严重的盐胁迫和多余的营养输入[14]; 海洋污染严重威胁着红树林的生存,沉积物中原油的浓度是造成红树白化的重要原因,红树科中4个胎生属以及白骨壤(Avicennia marina)的繁殖体都有白化现象发生[18-19]; 以牺牲湿地为代价的大量鱼塘和虾塘的修建更是严重缩减了红树林湿地面积,在我国的许多地方,前有海平面上升,后有堤坝的阻隔,红树林处于“进退两难”的境地.如何拯救这个脆弱的生态系统成为当前亟待解决的问题.
红树植物生长在河口潮间带,长期遭受高盐、低氧、周期性潮汐的冲刷以及海边强紫外线的辐射,为此进化出一系列与众不同的适应性性状[20-23].胎生作为一种特殊的繁殖方式,是红树植物最有趣且最显著的特征,被认为是红树植物为适应滨海湿地环境而进化出的最重要的机制之一,具有重要的生态适应性意义.胎生繁殖体所形成的幼苗(胚轴)是红树林恢复造林的优良种子来源,具有易获取、易操作、易存活等优点,对于解决红树林逐年退化的问题具有重要意义.然而,目前对红树胎生现象的遗传与分子机制了解很少,这主要是由于缺乏遗传与分子资源.近年发展起来的组学技术给这一科学问题提供了新的研究空间.本综述将从红树植物的适应性性状展开,从组学角度探讨红树植物胎生现象的研究现状及发展方向.
1 胎生红树研究进展
1.1 胎生现象及其生态意义植物胎生是一种特殊的种子发育与繁殖方式,是指种子不经过休眠、在母体上直接萌发的现象.目前已报道的胎生植物共25科78种[23].胎生植物大多生长在浅海海滩或潮间带,而非胎生植物大多生长在陆地或干旱地区,因此普遍认为这是胎生植物在长期适应特殊地理环境条件下所产生的一种独特的繁殖方式[24].按照萌发过程中胚轴是否突破果皮,可将胎生分为显胎生(vivipary)和隐胎生(cryptovivipary).显胎生是指胚胎在母体生长过程中先后突破种皮和果皮的现象,大多发生于红树植物以及两个属(Amphibolis和Thalassodendron)的海草中[25],少数发生在陆生种,最显著的是在红树科的红树属(Rhizophora)、秋茄树属(Kandelia)、角果木属(Ceriops)和木榄属(Bruguiera); 隐胎生是指繁殖体在萌发过程中只突破种皮而不突破果皮的现象,如分布在不同科的海榄雌属(Avicennia)、蜡烛果属(Aegiceras)、水椰属(Nypa)和假红树属(Pelliciera)[23].研究表明,显胎生与隐胎生在进化上有不同的起源[26].红树植物的胎生现象早在100多年前就已被观察记录[27],它的本质是连续的胚胎生长与种子萌发的过程(图1),被认为是对滨海湿地环境的适应.
(a)正红树(R.apiculata)的未成熟“双胞胎”,中国海南省三亚市;(b)在水中自定植的美洲大红树(R.mangle),
美国大沼泽地国家公园(Everglades National Park),箭头指示水平面;(c)尖叶秋茄(K.candel),
孟加拉Sundarban;(d)木榄(B.gymnorhiza),印度尼西亚巴厘岛;(e)红茄苳(R.mucronata),
印度尼西亚巴厘岛;(f)红茄苳的成熟种子(可达80 cm或更长),印度尼西亚巴厘岛.
胎生作为一种植物的繁育机制,关系子代个体存活,与物种的适应能力息息相关,受到强烈的自然选择; 并且这种机制也可决定幼体的定居能力,从而影响红树的种群增长和群落构建.红树的繁殖体能否顺利到达适于其生长的环境并成功定植是红树种群世代延续的关键.这一过程受到诸多因素的影响:在未离开母体之前繁殖体会遭到如螃蟹、昆虫等捕食者的捕食; 当繁殖体离开母体后会受到自身和环境两方面的影响,自身的因素包括繁殖体的形状、大小、密度、休眠周期、死亡率以及根的定植速度等,环境因素包括潮汐的强度、风的大小和方向、水温、盐度以及受捕食情况等,这些因素都决定繁殖体能否成功定植[28].
关于红树胎生的生态意义有两种假说:1)胎生是对高盐环境的适应.该观点的提出是基于以下假设,即潮间带的高盐环境会严重抑制种子的萌发,而胎生种子的下胚轴含有包括水在内的大量营养物质,可供刚定植幼苗的生长所需,故避开了这一脆弱的发育阶段[29-31].对绝大多数植物来说,种子休眠是适应陆地环境的重要特征,它们能在种子库中存活,度过不良环境,等待条件适宜时萌发; 然而,对于生活在滨海环境的红树植物而言,若种子进行休眠会没入水底或随水漂浮,很可能因为环境不适宜而始终无法正常萌发,所以胚胎的提前发育被认为是对高盐环境的适应,除携带营养外,后代可以在母体上对滨海环境因子提前适应.2)胎生与繁殖体扩散有关.由于环境恶劣,潮间带地区植物多样性较低,面临新的竞争者的机会也较小,繁殖体大多通过水流等非生物因素进行传播[32-33],这大大降低了胎生植物向外扩张的机会,因此胎生植物必须就近繁殖来扩大群落以抵御非胎生植物的入侵; 而胎生种子在母体上可以完善结构、储存能量与水分,胚轴迅速生长与成熟,进而有效地应对落地后的复杂环境[34],可以迅速生根定植,占据潮间带生态位.
1.2 胎生种子的特点及发育过程胎生现象是红树区别于其他物种最显著的一个特征.胎生种子具有以下特点,即从种子的形态学结构组成上来说,70%以上的胎生种子在果实中产生,并且种子较大(直径大于4 cm),其中在超过74%的种子中胚的占比很大,约为种子体积的1/2,而胚乳特别小或者没有[35-37].巨大的胚中储存着丰富的营养物质,而这些营养物质往往来自于母体的供给.在红树属中,与种皮相邻的最外层胚乳细胞特化出向内皱褶的壁,被称为转运细胞; 通过转运细胞,水分和养料得以从种皮向胚转运, 但随着胚的不断生长, 这层转运细胞被挤压,最后失去功能.Juncosa等[38]认为这层特殊的转运细胞与胎生发育有一定的关系,但转运机制目前尚不清楚.母体与胚胎之间这种独特的营养运输方式可能是胎生繁殖方式能够起源与进化的关键原因.
从普通种子发育过程来说,大部分植物的种子从受精到萌发会经过一系列内部的变化:1)受精后胚不断长大,胚根和胚芽等组织开始分化; 2)随着种子的长大,大量营养物质被储存下来,细胞发生液泡化; 3)种子进行脱水干燥,细胞代谢几乎停滞; 4)在适宜的环境下,种子开始吸水,代谢活化,营养物质被消耗; 5)胚芽和胚根突破种皮而完成萌发的过程.相比于这些普通种子,胎生种子会跳过第3和第4阶段而直接进入最后的萌发过程[35].在红树植物胎生发育过程中,部分物种有形态学解剖结构方面较详细的观察和描述[38-40].Cook根据美洲大红树的发育过程提出显胎生发育模式分为3个阶段[27]:子叶的第一次生长和下胚轴的生长和子叶的第二次生长.红树属、秋茄属、角果木属和木榄属的发育基本都符合这一模式,但在形态上各有特点.早期文献报道红树属、木榄属和秋茄属中均由大量生长的胚乳突破种皮,由于胚乳的剧烈增加,胚孔被迫打开,随后胚胎开始迅速生长,胚乳被吸收退化; 而角果木属则是依靠胚轴的伸长突破种皮发育的[38].然而周晓旋等[23]发现秋茄(K.obovata)并非依靠胚乳,而是由胚轴的伸长突破种皮完成萌发的,且在受精2周后的种子中没有发现胚乳,推测在更早期胚乳就已失去作用.可见,胚乳在不同方式的胎生植物中有着不同的作用.
另外,秋茄的种皮和果皮突破处都有明显的细胞疏松化,这极大地减小了胚轴生长突破的阻力.与休眠种子中种皮和胚乳起抑制萌发的作用不同[41],红树植物的胎生中种皮和胚乳可能有协助和促进萌发的作用.当胚胎突破种皮后,生长动力则来自下胚轴中居间分生组织的细胞分裂[23],这也与拟南芥(Arabidopsis thaliana)不同,后者靠下胚轴与胚根交界处的细胞分裂和伸长[42].在胚轴突出果皮前后,秋茄的胚根都没有分化,直到胚轴成熟时才能明显地观察到有内生性胚根,幼嫩的根尖外有由薄壁细胞组成的保护结构,初生长时根冠与其外的薄壁细胞连成一体,发育到后期时根冠与薄壁细胞之间出现裂缝.根据陈月琴等[43]的描述,这层薄壁细胞中有单宁,能更好地保护幼嫩的胚根; 且此时侧根从中柱鞘中发育,在胚轴下部的凸出即为侧根的突起,这些侧根在胚轴落地后才会伸出,协助胚轴完成直立生长,可以推测无论主根或侧根都在掉落前才发育成熟.与非胎生种子发育过程相比,红树植物的显胎生发育存在许多不同,这些结构上的不同很可能与红树植物胎生现象适应滨海湿地环境有关,还包含着丰富的植物种子发育多样性相关知识,有待对其进行深入的机制研究.
2 生态基因组学及其在红树胎生研究中的应用
3 问题与展望
尽管已有很多研究从不同的角度和水平对红树胎生进行解释,但是真正的机制研究还非常有限,仍有许多问题尚不清楚.1)红树胎生过程中的营养供给机制.对于非胎生种子而言,种子在发育的过程中,随着其逐渐长大,会以种子蛋白的形式储存大量营养物质,供种子后续萌发[77].但与此不同的是,显胎生红树种子在母体上萌发,那么种子是否有储存营养物质,还是依靠母体不断传送?如果是依靠母体传送,那么负责传送的器官或组织是什么?2)与非胎生红树相比,胎生红树基因组的特点是什么?3)直接影响红树胎生现象的重要基因有哪些?对于上述这些问题,目前的研究依旧没有取得突破性进展.一方面是机制研究在木本植物上具有一定局限性,除木本植物培育周期长外,主要是由于没有遗传突变体可供研究,也缺乏一个有效的转基因系统用于验证基因的功能; 另一方面是已全面、深度测序的红树物种依然很少,基因组注释不完整,导致不能进行深层次的机制研究.因此,希望今后的研究中可以有更多的红树基因组得到补充,为开展机制研究提供更多的基础信息.只有更多的胎生红树基因组被测序,才能全面地进行基因组比较分析,进而得知胎生红树与非胎生红树或者其近缘种在基因组上的差异.这些差异基因很可能就是导致胎生现象发生的关键,对于研究胎生现象具有极其重要的意义.
2.1 生态基因组学物种的DNA序列蕴含了生物体的遗传信息,基因组测序是解决许多生物学问题的关键.基因组学的兴起迅速推动了生命科学各研究领域的发展,是揭示物种生物学、遗传学特性以及物种进化关系最有效、最直接的手段之一.而生态基因组学是一个整合生态学、分子遗传学和进化基因组学的新兴交叉学科,其将基因组学的研究手段和方法引入生态学领域,通过群体基因组学、转录组学和蛋白质组学等方法将个体、种群、群落和生态系统这些不同层次的生态学相互作用整合起来,确定在生态学响应及相互作用中具有重要意义的关键基因和遗传途径,阐明这些基因和遗传途径变异的程度及其进化后的特征,从基因水平探索有机体响应天然环境(包括生物与非生物的环境因子)的遗传学机制.生态基因组学的研究对象可以分为模式生物与非模式生物两大类:拟南芥、酿酒酵母(Saccharomyces cerevisiae)等模式生物在生态基因组学领域早期发展发挥了重要作用; 随着基因组学技术的开发与完善,越来越多非模式生物生态基因组学的研究将为生态学的发展提供重要的理论与实践依据.生态基因组学最核心的方法包括寻找序列变异、研究基因差异表达和分析基因功能等,已广泛渗透到生态学相关领域中,将会在生物对环境的响应、物种间相互作用、进化生态学、入侵生态学、群落生态学、全球变化生态学等研究领域发挥更大的作用.基因组学方法除能揭示适应性外,对于起源和进化关系方面的研究也展示出其优势.随着我国“建设生态文明”战略的提出,越来越多学者也把目光转移到一些环保树木上,对滨海湿地起重要保护作用的红树得到重视.通过对红树的基因组测序,其起源与进化以及胎生现象等重要适应性特征的相关机制研究取得了重大进展,一些与此相关的基因和通路也相继被发掘.
2.2 生态基因组学在红树胎生研究中的应用2.2.1 胎生红树的起源与进化胎生现象由Goebel在1905年首次报道[44].然而胎生的起源与进化一直都处于争议中:Guppy[45]认为胎生是一种原始的性状,是在一个早期相对稳定的气候条件下进化而来的; van der Pijl[46]则认为胎生是在某一特定环境下演化而来的.对于包含4个显胎生属的红树科而言,起源假说也是讨论的热点.分子系统学的研究结果表明红树科为单起源[24,26],即红树科植物起源于共同的祖先,但其究竟是起源于陆生祖先还是海生祖先却不得而知.林鹏等[47]通过比较红树科、马鞭草科和海桑科中部分植物的次生木质部结构,认为红树植物演化的过程可能有两条途径:1)红树科植物可能起源于陆生祖先,随后向海陆两个方向分歧发展.由于海蚀或陆岸下沉,一部分陆生祖先向潮间带生境拓展,最终演化成为现存的海生红树族植物; 另一部分祖先则继续生存在陆地,最终演化为现存胎生红树的陆地近缘种一族.2)红树科植物起源于海生祖先,后来由于造陆作用和海蚀作用沿海陆两条途径演化.其中一部分登陆,最终演化为陆生红树科植物如竹节树(Carallia brachiata)等; 另一部分由于陆岸下沉向低潮区侵入,演化为潮间带红树一族.显然,林鹏等[47]认为红树科的胎生现象也是起源于特定的气候条件.
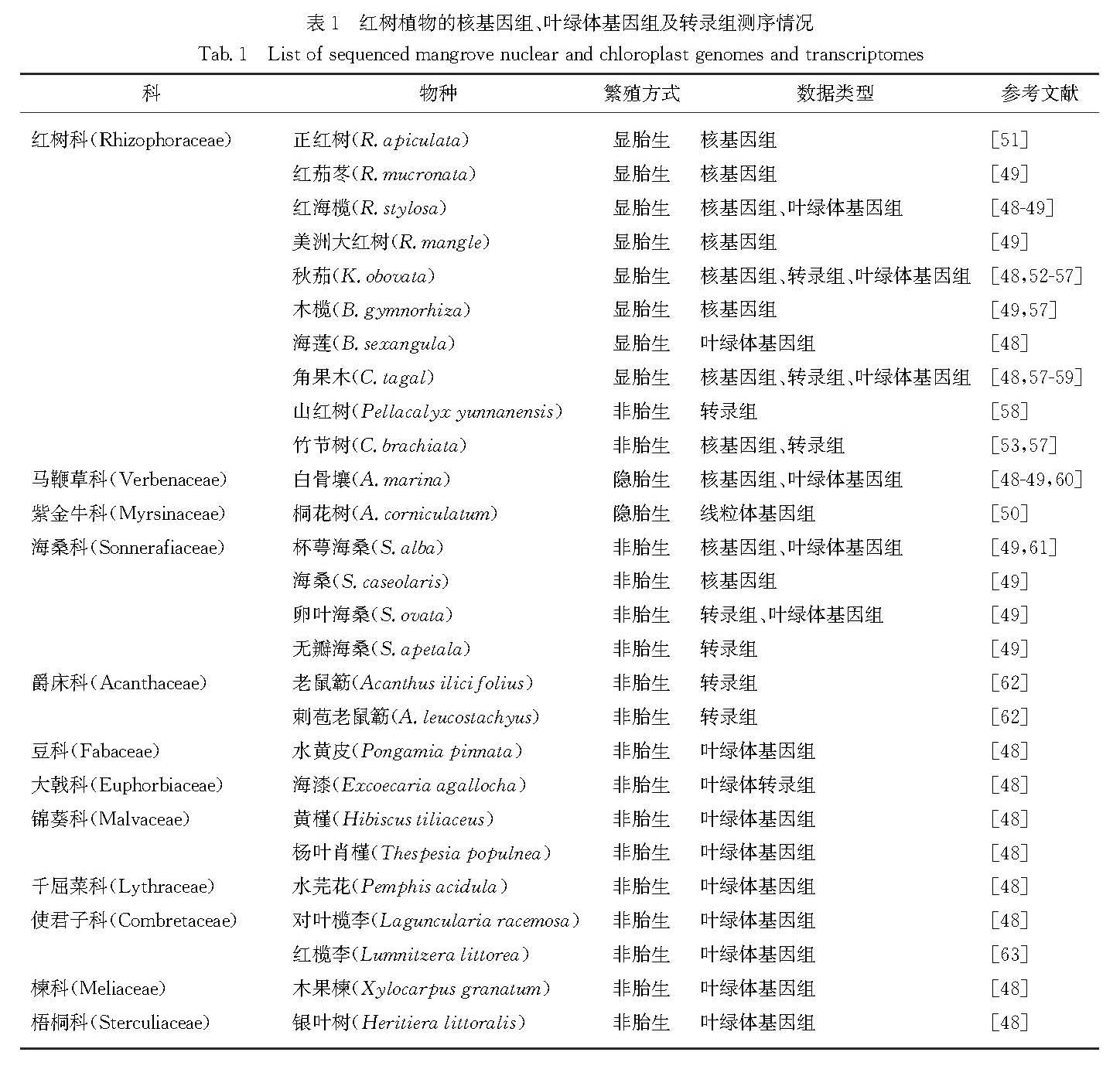
近年来随着DNA测序技术的发展,越来越多红树植物的核全基因组、叶绿体基因组以及线粒体基因组相继被测序[48-50],人们开始从组学水平探讨胎生红树的起源与进化.核基因组已测序的物种中,显胎生红树有红树科红树属的正红树、红茄苳、红海榄(R.stylosa)和美洲大红树,木榄属的木榄(B.gymnorhiza),秋茄属的秋茄,角果木属的角果木(C.tagal)等; 隐胎生红树有马鞭草科海榄雌属的白骨壤(A.marina); 非胎生红树有海桑科海桑属的海桑(Sonneratia caseolaris)和杯萼海桑(S.alba),红树科竹节树属竹节树(表1).
通过基因组研究发现[51,57]:红树科植物在约5 500 万年前起源于陆生祖先,由于古新世-始新世极热事件(Paleocene-Eocene thermal maximum,PETM),全球气温升高,极地冰雪融化,海平面上升,淹没了生长在热带雨林边缘的被子植物,迫使它们适应新的海洋环境; 随后在前4 800万~5 500万年间,红树科出现分化,此后红树科的红树属、秋茄属、角果木属及木榄属与山红树属及竹节树属发生进化分歧,前4个属以显胎生作为繁殖方式,而后2个属为非胎生.
红树科植物的基因组在发生分歧前都经历了基因组加倍事件.在进化的过程中基因组发生缩减,导致红树的基因组显著小于陆生木本植物的基因组[64].转座子含量的减少是引起其基因组减小的关键原因[65-66].Lyu等[65]报道,相比于其他29个非红树物种,4个真红树(即正红树、海桑、杯萼海桑和白骨壤)的基因组转座子含量显著降低.另有研究表明基因组大小与转座子活性呈正相关[67-68],转座子增殖的速度如果大于其灭亡的速度,那么基因组会随之越来越大[69-70].红树在缩减基因组的过程中,将一些冗余转座子以及基因家族丢弃,以此来减少整个基因组的负荷,留下那些对植物体生存必要的核心高效基因,这样植物便可集中全部能量用于对抗高盐和低氧等逆境胁迫.
2.2.2 胎生分子机制的研究截至目前,越来越多的研究开始从分子水平对胎生问题进行探索,大多集中在谷类作物和拟南芥突变体中.许多收获季节的谷类作物在遇到潮湿温热的环境时,其种子往往会在植株上萌发,这种现象被称为“熟前萌发”[71].拟南芥的一些基因突变体也会表现出胎生现象,这些突变体大多是因为基因的缺失,植物激素脱落酸(ABA)合成受阻,或者对ABA不敏感而导致的胎生现象[72].例如玉米(Zea mays)中编码ABA生物合成第一步反应所需黄质环氧化酶的突变体aba1和ABA不敏感型突变体abi3都表现出胎生现象,水稻(Oryza sativa)中的一些突变体如riv(rice vivipary)1-1、riv1-2和riv2等由于对ABA不敏感也表现出胎生现象[73-74].
表1 红树植物的核基因组、叶绿体基因组及转录组测序情况
Tab.1 List of sequenced mangrove nuclear and chloroplast genomes and transcriptomes在基因组层面对红树胎生机制的研究发现,胎生红树在基因组上有使用某些氨基酸的偏好,即氨基酸的替换可能对胎生和其他各种适应性性状的演化以及对滨海湿地环境的适应具有重要意义[49].同时,Xu等[51]对正红树基因组进行分析后发现有19个受到正选择的基因参与胚胎发育过程,包括在ABA合成与响应、乙烯代谢及响应中有重要作用的基因; 另外也发现赤霉素(GA)合成通路中的贝壳杉烯合成酶和GA3β-水解酶编码基因在基因组上发生随机加倍事件,且贝壳杉烯合成酶编码基因有9个拷贝,因此认为该基因的扩张可能与胎生现象有密切关系.Qiao等[57]通过对秋茄、木榄、角果木和竹节树的基因组测序以及比较分析,发现导致休眠的关键基因DOG1在胎生物种中共同缺失,这可能是引起胎生种子不休眠的关键原因之一; 然而,DOG1调控胎生过程的分子机制还有待研究,很可能是通过调节植物激素ABA与GA的代谢而实现的.
在秋茄的转录组研究中发现,胎生过程中内源ABA合成基因表达下调,对ABA响应的基因表达上调,说明胎生繁殖体存在降低ABA水平、减轻抑制发育的机制,以保证胎生的顺利发生[56].周晓旋[75]进一步对秋茄繁殖器官胎生的动态过程进行解剖学观察,发现共有7个关键阶段,包括:1)未受精的胚珠; 2)受精2周后的胚珠,萌发出绿色线性胚; 3)胚轴开始分化,但未突破种皮; 4)胚轴突破种皮; 5)胚轴即将突破果皮; 6)胚轴突破果皮; 7)主根和侧根开始分化.进而对这7个关键阶段进行转录组测序,发现基因表达在不同的发育阶段呈现时空差异,这些差异基因与GA、ABA、生长素、细胞分裂素等植物激素的合成与响应有关[75].Qiao等[57]发现在胚轴突破种皮的关键阶段,与GA合成相关的关键基因KAO的表达显著上调,负调控响应因子DELLA的表达则下调,导致胎生种子较普通种子而言有更高的GA含量; 与此同时,ABA合成的关键基因NCED以及响应因子ABF的表达显著下调,而编码降解ABA酶的基因CYP707A则在该阶段表达显著上调,其结果是胎生种子与非胎生种子相比具有极低的ABA水平.他们还发现ABA与GA等激素的代谢平衡不同于非胎生种子,特别是低水平的ABA可减轻对萌发的抑制,而高水平的GA使得胚胎持续生长,导致胎生[57].外源喷施实验证明ABA具有延缓秋茄胎生发育的作用; 从红树植物中克隆的几个与ABA响应有关的基因(如ABI1与ABI2)在外源ABA的刺激下,表达水平发生显著变化[56].
胎生过程的基因组和转录组分析还发现,一些种子蛋白的缺失可能与胎生过程的营养供给有关,使得种子必须依附于母体的营养输送或者胚胎自身的光合作用,才能满足种子萌发过程对营养的需求,这些关键基因的缺失共同影响了胎生的发生[57].对秋茄胚胎发育过程的转录组分析发现,一些差异表达基因显著富集在器官形态建成、光合作用等代谢通路,暗示胎生繁殖器官在发育过程中进行着营养合成,这可能与种子萌发过程的营养供给有关[56].
不仅如此,控制种子休眠的原花青素合成相关基因的表达在种皮中也明显下调,而该合成通路在非胎生近缘种竹节树的种子中表达呈现相反的趋势[57].另有研究发现种皮中原花青素的含量增加能够有效抑制种子萌发[76].在胎生种子的关键部位,原花青素合成骤减为胚胎突破种皮提供了先决条件,但这是原因还是发育的必然结果有待进一步研究.
由上可见,红树植物的胎生发育过程存在激素代谢和响应基因的变化,影响了激素合成及下游被调控的基因,从而抑制种子休眠同时促进萌发; 而胚胎和种子发育过程中母体的营养供给及萌发的机械屏障减少,都为胎生过程提供了有利的条件,最终使胎生发生.由于红树物种遗传材料的局限性,目前没有验证基因功能的转基因体系,对分子机制研究的手段有所不足,对红树的胎生等适应性研究仍停留在初步探索阶段.
- [1] LEE S Y,PRIMAVERA J H,DAHDOUH-GUEBAS F,et al.Ecological role and services of tropical mangrove ecosystems:a reassessment[J].Global Ecology & Biogeo-graphy,2014,23(7):726-743.
- [2] DUKE N C,MEYNECKE J O,DITTMANN S,et al.A world without mangroves?[J].Science,2007,317(5834):41-42.
- [3] ABDULLAH F R,HUSRIN S,BACHTIAR H.Experi-mental data analysis of wave attenuation in mangroves[J].Journal of Physics:Conference Series,2019,1245:012095.
- [4] DANIELSEN F.The Asian tsunami:a protective role for coastal vegetation[J].Science,2005,310(5748):643.
- [5] MENÉNDEZ P,LOSADA I J,TORRES-ORTEGA S,et al.The global flood protection benefits of mangroves[J].Scientific Reports,2020,10(1):4404.
- [6] MANIK H,SOLIN M,THAMI K,et al.Fortification of chitosan and mangrove flour as windu shrimp feed(Penaeus monodon)against infection white spot syndrome virus[J].IOP Conference Series:Materials Science and Engineering,2020,725:012071.
- [7] TANNER M K,MOITY N,COSTA M T,et al.Mangroves in the Galapagos:ecosystem services and their valuation[J].Ecological Economics,2019,160:12-24.
- [8] DHEANISA M R,HANDAYANI T,SUSILONINGTY-AS D,et al.The relationship between shrimps production and mangrove ecosystem in Indramayu Regency[J].IOP Conference Series:Earth and Environmental Science,2020,429:012055.
- [9] VAN HIEU P,HOANG HA N T,VIET DUNG L,et al.Carbon sources supporting macro-invertebrate communities in restored mangrove forests from Hau Loc,Thanh Hoa,Vietnam[J].Journal of Marine Science and Engineering,2020,8(9):651.
- [10] DONATO D C,KAUFFMAN J B,MURDIYARSO D,et al.Mangroves among the most carbon-rich forests in the tropics[J].Nature Geoence,2011,4(5):293-297.
- [11] 何琴飞,范航清,莫竹承.人为干扰对滨海红树林湿地的影响[J].湿地科学与管理,2009,5(3):44-46.
- [12] 廖宝文,张乔民.中国红树林的分布、面积和树种组成[J].湿地科学,2014,12(4):435-440.
- [13] HAMILTON S E.Mangroves and aquaculture:a five decade remote sensing analysis of ecuador's estuarine environments[M].[S.l.]:Springer,2020.
- [14] ADAME M F,REEF R,SANTINI N S,et al.Mangroves in arid regions:ecology,threats,and opportunities[J].Estuarine,Coastal and Shelf Science,2020,248(10):106796.
- [15] 彭逸生,周炎武,陈桂珠.红树林湿地恢复研究进展[J].生态学报,2008,28(2):336-347.
- [16] FRIESS D A,ROGERS K,LOVELOCK C E,et al.The state of the world's mangrove forests:past,present,and future[J].Annual Review of Environment and Resou-rces,2019,44(1):89-115.
- [17] SAINTILAN N,KHAN N S,ASHE E,et al.Thresholds of mangrove survival under rapid sea level rise[J].Science,2020,368(6495):1118-1121.
- [18] DUKE N C,WATKINSON A J.Chlorophyll-deficient propagules of Avicennia marina and apparent longer term deterioration of mangrove fitness in oil-polluted sediments[J].Marine Pollution Bulletin,2002,44(11):1269-1276.
- [19] VELDKORNET D,RAJKARAN A,PAUL S,et al.Oil induces chlorophyll deficient propagules in mangroves[J].Marine Pollution Bulletin,2020,150:110667.
- [20] 刘逸泠,覃盈盈,郑海雷.红树植物耐水淹和高盐适应性研究进展[J].厦门大学学报(自然科学版),2017,56(3):314-322.
- [21] 段贤朋,黄伟,吴辉,等.红树植物盐胁迫适应机制研究进展[J].湖南农业科学,2012(12):35-37.
- [22] 陈鹭真,林鹏,王文卿.红树植物淹水胁迫响应研究进展[J].生态学报,2006,26(2):586-593.
- [23] 周晓旋,蔡玲玲,傅梅萍,等.红树植物胎生现象研究进展[J].植物生态学报,2016,40(12):1328-1343.
- [24] SCHWARZBACH A E,RICKLEFS R E.Systematic affinities of Rhizophoraceae and Anisophylleaceae,and intergeneric relationships within Rhizophoraceae,based on chloroplast DNA,nuclear ribosomal DNA,and morphology[J].American Journal of Botany,2000,87(4):547-564.
- [25] KUO J,KIRKMAN H.Anatomy of viviparous seagrasses seedlings of Amphibolis and Thalassodendron and their nutrient supply[J].Botanica Marina,1990,33(1):117-126.
- [26] SHI S H,HUANG Y L,ZENG K,et al.Molecular phylogenetic analysis of mangroves:independent evolutionary origins of vivipary and salt secretion[J].Molecular Phylogenetics and Evolution,2005,34(1):159-166.
- [27] COOK M T.The embryology of Rhizophora mangle[J].Bullentin of the Torrey Botanical Club,1907,34(6):271-277.
- [28] VAN DER STOCKEN T,WEE A K S,DE RYCK D J R,et al.A general framework for propagule dispersal in mangroves[J].Biological Reviews,2019,94(4):1547-1575.
- [29] JOSHI A C.A suggested explanation of the prevalence of vivipary on the sea-shore[J].Journal of Ecology,1933,21(1):209-212.
- [30] GENKEL P.The concept of vivipary in the plant world[J].Zhurnal Obshchei Biologii,1979,40(12):60-66.
- [31] HAN J X,WEI Y,YAN C,et al.The vivipary characteristic of Anabasis elatior and its ecological adaptation[J].Acta Ecologica Sinica,2011,31(10):2662-2668.
- [32] RABINOWITZ D.Dispersal properties of mangrove propagules[J].Biotropica,1978,10(1):47-57.
- [33] MCKEE K L.Mangrove species distribution and propagule predation in Belize:an exception to the dominance-predation hypothesis[J].Biotropica,1995,27(3):334-345.
- [34] 闫中正,王文卿,黄伟滨.红树胎生现象及其对潮间带生境适应性研究进展[J].生态学报,2004,24(10):2317-2323.
- [35] FARNSWORTH E.The ecology and physiology of viviparous and recalcitrant seeds[J].Annual Review of Ecology & Systematics,2000,31(1):107-138.
- [36] MOLES A T,WESTOBY M.Seedling survival and seed size:a synthesis of the literature[J].Journal of Ecology,2010,92(3):372-383.
- [37] VANDELOOK F,DICKIE J,CARTA A.Evolution and functional ecology of the embryo to seed size ratio[C]∥Conference of Seed Ecology.Regensburg:[s.n],2019.
- [38] JUNCOSA A M,TOMLINSON P B.Systematic comparison and some biological characteristics of Rhizophoraceae and Anisophylleaceae[J].Annals of the Missouri Botanical Garden,1988,75(4):1296-1318.
- [39] SMAIL F A,NITSCH L M C,WOLTERS-ARTS M MC,et al.Semi-viviparous embryo development and dehydrin expression in the mangrove Rhizophora mucronata Lam[J].Sexual Plant Reproduction,2010,23(2):95-103.
- [40] TOBE H,RAVEN P H.Seed morphology and anatomy of Rhizophoraceae,inter-and infrafamilial relationships[J].Annals of the Missouri Botanical Garden,1988,75(4):1319-1342.
- [41] HAUGHN G,CHAUDHURY A.Genetic analysis of seed coat development in Arabidopsis[J].Trends in Plant Science,2005,10(10):472-477.
- [42] KARIN W,KERSTIN M,GERHARD L M.First off the mark:early seed germination[J].Journal of Experimental Botany,2011,(10):3289-3309.
- [43] 陈月琴,蓝崇钰,黄玉山,等.秋茄木榄繁殖体的结构及其生态特异性[J].中山大学学报(自然科学版),1995,34(4):70-75.
- [44] GOEBEL K.Organography of plants[M].New York:Hafner,1905.
- [45] GUPPY H B.Observations of a naturalist in the Pacific between 1896 and 1899[J].Nature,1906,75(12):111.
- [46] VAN DER PIJL L.Principles of dispersal in higher plants[M].3rd ed.Berlin:Springer,1982.
- [47] 林鹏,林益明,林建辉.红树植物次生木质部的结构与进化[J].海洋学报,1998,20(4):3-5.
- [48] SHI C C,HAN K,LI L W,et al.Complete chloroplast genomes of 14 mangroves:phylogenetic and comparative genomic analyses[J].Biomed Research International,2020,2020:8731815.
- [49] HE Z W,XU S H,ZHANG Z,et al.Convergent adaptation of the genomes of woody plants at the land-sea interface[J].National Science Review,2020,7(6):978-993.
- [50] ZHANG J W,ZHANG S J,ZHANG Y.The complete mitochondrial genome of a mangrove plant:Aegiceras corniculatum and its phylogenetic implications[J].Mitochondrial DNA Part B,2020,5(2):1502-1503.
- [51] XU S H,HE Z W,ZHANG Z,et al.The origin,diversification and adaptation of a major mangrove clade(Rhizophoreae)revealed by whole-genome sequencing[J].National Science Review,2017,4(5):721-734.
- [52] DU Z K,LI J M,YANG D.The complete chloroplast genome of a mangrove Kandelia obovata Sheue,Liu & Yong[J].Mitochondrial DNA Part B,2019,4(2):3414-3415.
- [53] GUO W X,WU H D,ZHANG Z,et al.Comparative analysis of transcriptomes in Rhizophoraceae provides insights into the origin and adaptive evolution of mangrove plants in intertidal environments[J].Frontiers in Plant Science,2017,8:795.
- [54] SU W Y,YE C T,ZHANG Y H,et al.Identification of putative key genes for coastal environments and cold adaptation in mangrove Kandelia obovata through transcriptome analysis[J].Science of the Total Environment,2019,681:191-201.
- [55] YANG Y,ZHANG Y,CHEN Y K,et al.Complete chloroplast genome sequence of the mangrove species Kandelia obovata and comparative analyses with related species[J].PeerJ,2019,7(4):e7713.
- [56] HONG L W,SU W Y,ZHANG Y Y,et al.Transcri-ptome profiling during mangrove viviparity in response to abscisic acid[J].Scientific Reports,2018,8(1):770.
- [57] QIAO H M,ZHOU X X,SU W Y,et al.The genomic and transcriptomic foundations of viviparous seed deve-lopment in mangroves[EB/OL].[2020-10-01].http:∥biorxiv.org/content/10.1101/2020.10.19.346163.
- [58] YANG Y C,YANG S H,LI J F,et al.De novo assembly of the transcriptomes of two yellow mangroves,Ceriops tagal and C.zippeliana,and one of their terrestrial relatives,Pellacalyx yunnanensis[J].Marine Genomics,2015,23:33-36.
- [59] CHEN Y K,YANG Y,LI J W,et al.The complete chloroplast genome sequence of a medicinal mangrove tree Ceriops tagal and its phylogenetic analysis[J].Mitochondrial DNA Part B,2019,4(1):267-268.
- [60] FRIIS G,VIZUETA J,NELSON D R,et al.A high-quality genome assembly and annotation of the gray mangrove,Avicennia marina[EB/OL].[2020-10-01].http:∥biorxiv.org/content/10.1101/2020.05.30.124800.
- [61] YU T H,HINSINGER D D,STRIJK J S,et al.The first complete chloroplast genome of a major mangrove species Sonneratia alba Sm.and its implications on conservation efforts[J].Mitochondrial DNA Part B,2018,3(2):500-502.
- [62] YANG Y C,YANG S H,LI J F,et al.Transcriptome analysis of the Holly mangrove Acanthus ilicifolius and its terrestrial relative,Acanthus leucostachyus,provides insights into adaptation to intertidal zones[J].BMC Genomics,2015,16:605.
- [63] ZHOU Q J,CHEN Y M,WU W,et al.The complete chloroplast genome sequence of an endangered mangrove tree Lumnitzera littorea(Combretaceae)[J].Conserva-tion Genetics Resources,2018,10(4):911-913.
- [64] GAUT B S.A convergent outcome:small genomes in mangroves[J].New Phytologist,2018,217(1):5-7.
- [65] LYU H M,HE Z W,WU C I,et al.Convergent adaptive evolution in marginal environments:unloading transpo-sable elements as a common strategy among mangrove genomes[J].New Phytologist,2018,217(1):428-438.
- [66] WANG Y S,LIANG W Q,TANG T.Constant conflict between Gypsy LTR retrotransposons and CHH me-thylation within a stress-adapted mangrove genome[J].New Phytologist,2018,220(3):922-935.
- [67] VINOGRADOV A E.Genome size and extinction risk in vertebrates[J].Proceedings Biological Sciences,2004,271(1549):1701-1705.
- [68] VINOGRADOV A E.Evolution of genome size:multilevel selection,mutation bias or dynamical chaos?[J].Current Opinion in Genetics & Development,2004,14(6):620-626.
- [69] BROOKFIELD J F Y.The ecology of the genome-mobile DNA elements and their hosts[J].Nature Reviews Genetics,2005,6(2):128-136.
- [70] LISCH D.How important are transposons for plant evolution?[J].Nature Reviews Genetics,2013,14(1):49-61.
- [71] GUBLER F,MILLAR A A,JACOBSEN J V.Dormancy release,ABA and pre-harvest sprouting[J].Current Opinion in Plant Biology,2005,8(2):183-187.
- [72] MEINKE D W,FRANZMANN L H,YEUNG N E C.Leafy cotyledon mutants of Arabidopsis[J].The Plant Cell,1994,6(8):1049-1064.
- [73] ROBERTSON D S.The Genetics of vivipary in maize[J].Genetics,1955,40(5):745-760.
- [74] KURATA N,MIYOSHI K,NONOMURA K I,et al.Rice mutants and genes related to organ development,morphogenesis and physiological traits[J].Plant Cell Physiology,2005,46(1):48-62.
- [75] 周晓旋.红树植物秋茄(Kandelia obovata)显胎生发育过程形态学观察及转录组分析研究[D].厦门:厦门大学,2017.
- [76] JIA L G,WU Q Y,YE N H,et al.Proanthocyanidins inhibit seed germination by maintaining a high level of abscisic acid in Arabidopsis thaliana[J].Journal of Integrative Plant Biology,2012,54(9):663-673.
- [77] SHEWRY P R,NAPIER J A,TATHAM A S.Seed storage proteins:structures and biosynthesis[J].The Plant Cell,1995,7(7):945-956.