(厦门大学生命科学学院,福建 厦门 361102)
(School of Life Sciences,Xiamen University,Xiamen 361102,China)
caffeic acid morpholine amine; tyrosinase; activation; melanin synthesis
DOI: 10.6043/j.issn.0438-0479.201702038
备注
合成了2种新型咖啡酸衍生物咖啡酸-2-氨乙基吗啉胺(C-1)和咖啡酸-N-氨丙基吗啉胺(C-2),并通过质谱、核磁共振以及红外光谱技术鉴定其结构.2种化合物对蘑菇酪氨酸酶具有良好的激活效果,其对于酪氨酸酶活性的半激活质量浓度(EC50)分别为0.06和0.12 mmol/L,且2种化合物的激活类型均为混合型激活.通过紫外-可见光谱法验证了C-1和C-2对酪氨酸酶的激活作用.通过荧光猝灭和分子模拟进一步分析了2种化合物与酪氨酸酶之间的相互作用,结果表明两者对酪氨酸酶的影响可能是基于化合物的碳链长度.2种化合物对人体正常肝细胞LO2无毒性,并能够增强人体黑色素瘤细胞M14中的酪氨酸酶活力.进而对M14细胞中黑色素合成相关蛋白的研究发现,2种化合物对酪氨酸酶蛋白(TYR)、酪氨酸酶家族相关蛋白(TRP-1和TRP-2)以及α-促黑色素激素(α-MSH)的表达量均起上调作用.综上所述,该化合物有望提供一种有效治疗酪氨酸酶失调的新方法.
Two new caffeic acid derivatives,caffeic acid-2-aminoethyl morpholine amine(C-1)and caffeic acid-N-propyl ammonia morpholine amine(C-2)were synthesized and their structures were characterized by LC-MS,1H-NMR and IR.The activation effects of these compounds on tyrosinase activities were evaluated.Compounds C-1 and C-2 showed potent activation effects,and the EC50 values were 0.06 mmol/L and 0.12 mmol/L on the tyrosinase activities respectively.Moreover,the activatory mechanisms were determined to be mixed activating type,and the activation effects were then verified using ultraviolet and visible spectrometry.Interactions of the compounds with tyrosinase were further analyzed using fluorescence quenching and molecular simulation assays.The results indicated that their effects on the tyrosinase activity maybe related to the length of carbon chain of the compounds.In addition,the compounds showed no cytotoxicity on human hepatic LO2 cells,and treatment of the human M14 melanoma cells with two compounds increased intracellular tyrosinase activity.The expression levels of TYR,TRP-1,TRP-2 and α-MSH protein were up-regulated in a dose-dependent manner by compounds treatment.These results suggested that compounds C-1 and C-2 might represent a novel approach for an effective therapy for tyrosinase failure diseases.
引言
酪氨酸酶(EC 1.14.18.1,tyrosinase)又称为多酚氧化酶,是一种含铜的金属酶,广泛存在于微生物、动植物和人体中[1].它具有单酚酶活性和二酚酶活性,能将酪氨酸羟化,产生邻位二羟基苯丙氨酸(L-DOPA),然后再将L-DOPA氧化成多巴醌,进一步生成一系列引起褐化的色素类物质[2].已有研究发现黑色素的生物合成由3种黑色素细胞特异酶催化:酪氨酸酶蛋白(TYR)、酪氨酸酶家族相关蛋白(TRP-1和TRP-2)[3-4].酪氨酸酶的异常表达可直接或间接导致人类疾病,如恶性黑色素瘤、皮肤斑点[5]和白癜风.黑色素对于人体的皮肤保护和内环境平衡是不可或缺的,适当的生产黑色素对皮肤的健康非常重要[6].近期的研究表明,白癜风患者的肾上腺皮质系统存在缺陷[7],需通过皮下注射来进行临床治疗.目前用于治疗白癜风的药物,绝大部分是从中草药中提取出有效成分制成的中成药,例如类黄酮、芹黄素和淫羊藿[8]等,通过化学合成得到的相关药物很少.
咖啡酸又称为3,4-二羟基肉桂酸,是一种天然存在的酚酸,属于多羟基苯乙烯酸类化合物,广泛存在于林产植物中,如山楂、沙棘和升麻等.最近,一些研究表明咖啡酸及其衍生物具有多种生物活性,包括抗肿瘤、抗炎、抗氧化[9]等.特别是咖啡酸酯类衍生物,如咖啡酸苯乙酯已经引起了相当大的关注[10].根据本课题组之前的研究,咖啡酸对蘑菇酪氨酸酶的单酚酶和二酚酶具有激活作用[11].本研究合成了2种新型咖啡酸吗啉胺衍生物咖啡酸-2-氨乙基吗啉胺(C-1)和咖啡酸-N-氨丙基吗啉胺(C-2),并通过质谱(MS)、核磁共振(NMR)以及红外光谱(IR)技术鉴定其结构,进而研究了C-1和C-2对蘑菇酪氨酸酶的激活效果和机制以及对黑色素合成代谢途径的影响,以期为治疗酪氨酸酶低表达引起的相关疾病提供理论依据.
1 材料与方法
2 结果与分析
2.1 咖啡酸吗啉胺的合成路径及结构鉴定咖啡酸吗啉胺的合成路径如图1所示,纯化后得到黄色粉末,进行结构鉴定,结果如下:
C-1的IR鉴定(KBr,νmax,cm-1):3 431.28(—OH),1 652.72(C=O),1 276.90(C—N),1 113.07(C—O),968.38(C=C).1H-NMR鉴定(600 MHz,DMSO):δ 8.04(t,J=5.7 Hz,1H),7.23(s,1H),7.20(s,1H),6.96(t,J=4.0 Hz,1H),6.85(d,J=2.1 Hz,1H),6.83(d,J=2.0 Hz,1H),6.77(d,J=3.0 Hz,1H),6.76(s,1H),6.74(s,1H),6.37(s,1H),6.34(s,1H),2.90(d,J=3.3 Hz,1H),2.89(d,J=4.2 Hz,1H),2.88(s,1H),2.64(s,1H),2.55(s,5H).LC-MS鉴定(m/z):测定值293.26 [M+H]+; 理论值292.35 [M]+.
C-2的IR鉴定(KBr,νmax,cm-1):3 473.65(—OH),1 653.73(C=O),1 271.73(C—N),1 118.87(C—O),980.00(C=C).1H-NMR鉴定(600 MHz,DMSO):δ 8.06(t,J=5.6 Hz,1H),7.23(s,1H),7.20(s,1H),6.95(d,J=2.0 Hz,1H),6.87(d,J=2.0 Hz,1H),6.85(d,J=2.0 Hz,1H),6.83(d,J=2.0 Hz,1H),6.75(s,1H),6.74(s,1H),6.33(s,1H),6.31(s,1H),3.18~3.16(m,2H),2.51(dt,J=3.6,1.8 Hz,2H),2.48(s,1H),2.36~2.31(m,5H),2.28(d,J=7.4 Hz,2H).LC-MS鉴定(m/z):测定值307.63 [M+H]+; 理论值306.37 [M]+.
2.2 化合物对酪氨酸酶的激活作用(a)C-1和C-2作用下的酪氨酸酶活力测定;(b)和(c)分别为C-1和C-2的Lineweaver-Burk双倒数作图,其中曲线0~4对应的
C-1浓度依次为0,0.125,0.250,0.375,0.500 mmol/L,C-2浓度依次为0,0.025,0.050,0.075,0.100 mmol/L.
图2 咖啡酸衍生物对酪氨酸酶的激活作用以及激活类型
Fig.2 Activation activity of caffeic acid derivatives on tyrosinase activity and determination of the activation type of tyrosinase从图2(a)可以看出,C-1和C-2对酪氨酸酶均具有明显的激活作用,其半激活质量浓度(EC50)分别为0.06和0.12 mmol/L,由此可见,C-1对酪氨酸酶的激活效果约为C-2的2倍.由图2(b)和(c)可知,Lineweaver-Burk双倒数作图均为相交于第二象限的一组直线,直线纵轴截距和直线斜率随着化合物浓度增大而减小,因此可以判断C-1和C-2对酪氨酸酶的激活类型均属于混合型激活.
(a)~(c)分别为体系中未加化合物、加入0.05 mmol/L C-1和C-2在连续时间内L-DOPA氧化产物的累积光谱图,其中
曲线0表示化合物在该波长范围内的光谱,曲线1~11分别代表加入酪氨酸酶0~10 min后的光谱.(d)和(e)分别为不同浓度的
C-1和C-2在相同时间(10 min)内L-DOPA氧化产物的累积光谱图,其中曲线0~6对应的C-1加入浓度依次为0,0.075,
0.150,0.225,0.300,0.375和0.450 mmol/L,C-2加入浓度依次为0,0.015,0.030,0.045,0.060,0.075和0.090 mmol/L.
图3 咖啡酸衍生物对酪氨酸酶催化氧化作用的全波长扫描分析
Fig.3 Full wavelength scanning analysis of caffeic acid derivatives on tyrosinase catalytic oxidation图3(a)是L-DOPA在未加化合物的情况下,酪氨酸酶催化氧化作用不同时间后的紫外-可见光谱,475 nm处特征峰的累积量为0.41.由图3(b)和(c)可以看出,在体系中添加C-1和C-2,10 min后产物累积量分别增加了78%和58%.由图3(d)和(e)可以看出,随着C-1和C-2浓度的增加,475 nm处的吸收峰也在不断地增加.该结果进一步佐证了2种化合物对酪氨酸酶的激活作用.
2.3 化合物与酪氨酸酶的相互作用从图4(a)和(b)可以看出,酪氨酸酶的荧光强度随着C-1和C-2浓度的增大而有规律地降低,且荧光发射波长出现略微红移.以F0/F对C-1和C-2终浓度c(Q)作图,得到化合物对酪氨酸酶荧光强度的Stern-Volmer曲线,如图4(c)和(d)所示.通过计算可知,C-1和C-2的荧光猝灭速率常数Ksv分别为7.06×10-6 和1.31×10-5 L/mol; 其动态猝灭速率常数Kq分别为706和13.1 L/(mol·s),均远小于各类猝灭剂对生物大分子的最大Kq值2.0×1010 L/(mol·s),说明C-1和C-2对酪氨酸酶的荧光猝灭均属于动态猝灭机制.
(a)和(b)分别为C-1和C-2作用下酪氨酸酶的荧光谱图,(a)中曲线0~10对应的C-1加入浓度依次为0,0.01,0.02,0.03,
0.04,0.05,0.06,0.07,0.08,0.09,0.10 μmol/L,(b)中曲线0~8对应的C-2加入浓度依次为 0,0.02,0.04,0.06,
0.08,0.10,0.12,0.14,0.16 μmol/L;(c)和(d)分别为不同浓度的C-1和C-2对酪氨酸酶荧光强度的Stern-Volmer曲线.
图4 不同浓度的咖啡酸衍生物对酪氨酸酶荧光强度的影响
Fig.4 Impacts on changes of tyrosinase fluorescence by different concentrations of caffeic acid derivatives通过分子对接模拟进一步探索了C-1、C-2与酪氨酸酶的对接模式以及酶催化部位,受体所暴露的差异性可通过与氨基酸残基结合的强度显示.从图5的对接构象可以看出,2种化合物均不能与酪氨酸酶的金属铜离子相互作用,但可与活性中心的氨基酸残基相互作用.如图5(a)所示:C-1氨基上的自由氢可以与酪氨酸酶活性中心的Asn260残基形成氢键,杂环供氧可以与Asn260和His244残基形成氢键,这些结构能够改变蛋白质的构象; 此外,C-1还能与活性中心的Val248、Val283、His61、His85、His263、His259、Phe90、Phe264和Glu256残基相互作用.如图5(b)所示:C-2氨基上的自由氢可以与酪氨酸酶活性中心的Asn260残基形成氢键,杂环供氧可以与His61残基形成氢键,这些结构能够改变蛋白质的构象; 此外,C-2还能与活性中心的Val283、His94、His85、His263、His259、Phe264、Phe292、Phe90、Ala286、Arg268、Ser282、Thr84和Glu256残基相互作用.
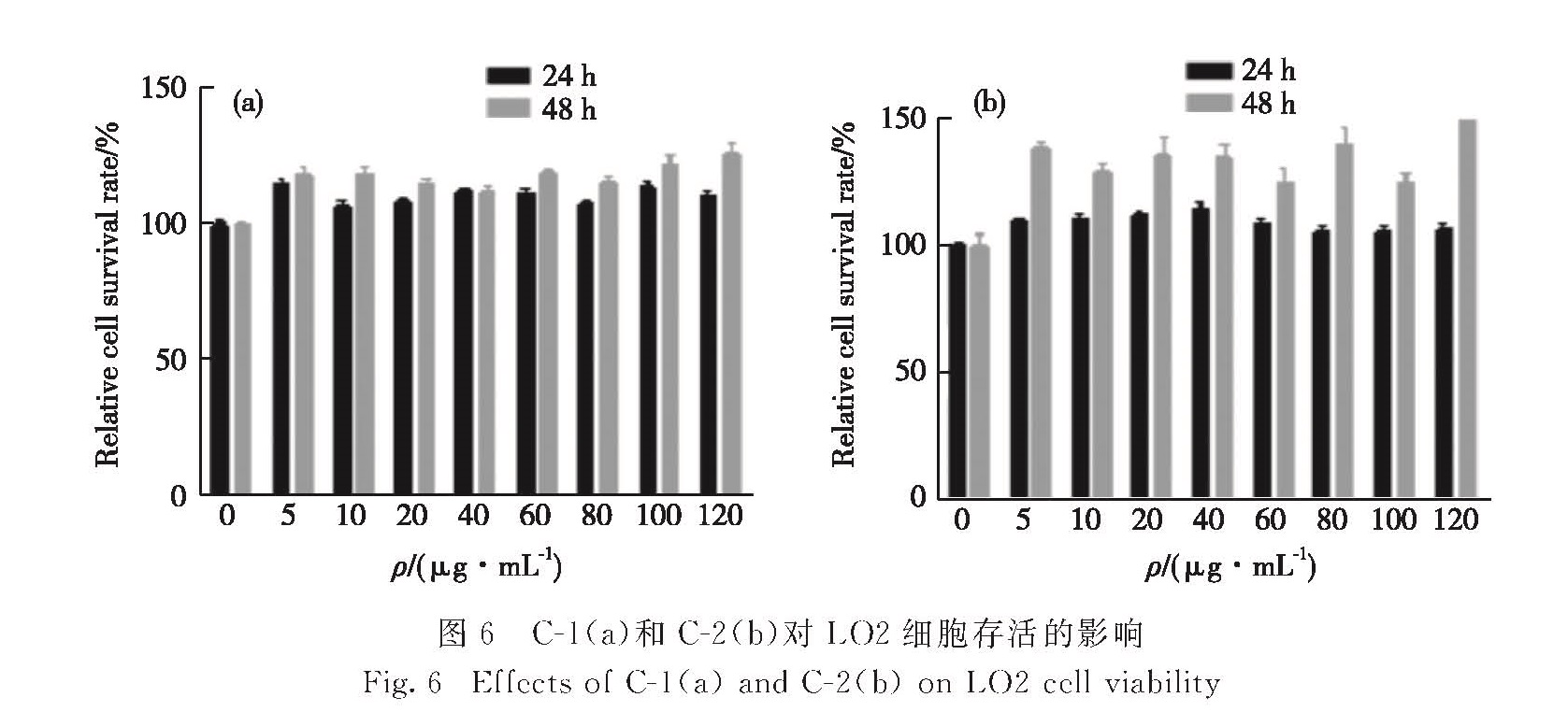
2.4 化合物对人正常肝细胞LO2的毒理试验通过MTT法检测化合物对人体正常肝细胞LO2的影响.如图6所示,LO2细胞在经过不同质量浓度(5,10,20,40,60,80,100,120 μg/mL)的C1和C2处理24 h后,处理组与对照组之间并无明显差异,而处理48 h后对LO2细胞的存活有一定促进作用,说明C-1和C-2无细胞毒性.
2.5 化合物对M14细胞内酪氨酸酶的激活作用由图7可以看出,在浓度为0,0.1,0.2,0.3,0.4和0.5 mmol/L 的C-1和C-2的作用下,M14细胞内酪氨酸酶活力增加,且激活作用呈现出浓度依赖性.相同浓度下,C-2对酪氨酸酶的激活效果比C-1好.
2.6 化合物对黑色素合成蛋白表达量的影响通过蛋白免疫印迹法检测化合物对M14细胞中黑色素合成相关蛋白表达量的影响.由图8可以看出,化合物C-1和C-2对TYR、TRP-1、TRP-2和α-MSH蛋白的表达量均起上调作用,而内参GAPDH蛋白的表达量无明显变化.
3 讨 论
本研究中合成了2种新型的咖啡酸衍生物C-1和C-2,并分析发现其对酪氨酸酶具有较好的激活作用,激活类型均属于混合型激活,其中C-1的激活效果更好,初步推测可能与碳链的长短有关.
图8 C-1(a)和C-2(b)对M14细胞内TYR、TRP-1、TRP-2和α-MSH蛋白表达量的影响
Fig.8 Effects of C-1(a)and C-2(b)on TYR,TRP-1,TRP-2 and α-MSH expression levels in M14 cells荧光猝灭法经常被用来研究配体与蛋白质之间的相互作用.本研究结果显示酪氨酸酶的荧光强度随着C-1和C-2浓度的增大而降低,然而酪氨酸酶的荧光发射光谱并没有随着C-1和C-2浓度的增大而发生明显的转变,由此可知化合物与酪氨酸酶之间的相互作用只影响与酪氨酸酶的荧光基团紧密相连的微环境,而直接环境中的猝灭残留物并没有发生变化.C-1和C-2能够使酪氨酸酶的最大荧光发射峰随着浓度的增加而发生略微的红移,对酪氨酸酶的荧光猝灭属于动态猝灭机制.此外,随着C-1和C-2浓度的增加,其对应的猝灭速率常数Ksv也增大.比较2种化合物的趋势变化,酪氨酸酶与C-1之间呈现出更强的相互作用,而与C-2之间的相互作用较弱,这与酶活测定实验的结果一致.
在分子对接的模拟中,C-1和C-2没有直接绑定到酪氨酸酶活性中心的铜离子,而主要和酪氨酸酶的氨基酸残基,如Asn260等形成氢键.这些结构可能改变蛋白质的构象,从而影响酪氨酸酶活力.
在细胞水平上研究发现C-1和C-2对人体正常肝细胞LO2没有毒害作用; 此外,C-1和C-2还能增强人体黑色素瘤细胞M14内的酪氨酸酶活力.通过蛋白免疫印迹进一步研究发现,C-1和C-2对M14细胞内的TYR、TRP-1、TRP-2和α-MSH几个黑色素合成相关蛋白的表达量均起上调作用.因此,化合物可有效地提高细胞黑色素生成量.
综上,本研究合成了2种新型的无毒化合物,具有改善细胞黑色素合成调控的功能,对应用于化妆品和制药原料有潜在开发价值,且涉及到的咖啡酸衍生物合成及其对酪氨酸酶激活作用的研究方法,为治疗酪氨酸酶低表达引起的相关疾病提供了理论依据.
1.1 材 料蘑菇酪氨酸酶(后简称酪氨酸酶)购于Sigma公司(St. Louis,MO,USA),酶活力为6 680 U/mg; 1-乙基-3-(3-二甲氨丙基)碳二亚胺盐酸盐(EDC·HCl)、4-二甲氨基吡啶(DMAP)、L-DOPA购于Aldrich 公司(St. Louis,MO,USA); 咖啡酸购于TCI公司(上海,中国); 2-氨乙基吗啉、N-氨丙基吗啉、N-甲基吗啉购于Sigma 公司(St.Louis,MO,USA); TYR抗体和α-促黑色素激素(α-MSH)抗体购于Abcom 公司(Cambridge,England); TRP-1抗体和内参蛋白甘油醛-3-磷酸脱氢酶(GAPDH)抗体购于Proteintech公司(Chicago,USA); TRP-2抗体购于Thermo Scientific公司(Waltham,MA,USA); 羊抗鼠IgG和羊抗兔IgG购于生工生物工程有限公司(上海,中国); 其他试剂均购于国药集团化学试剂有限公司,分析纯; 使用的蒸馏水为去离子重蒸水.
1.2 仪 器傅里叶IR仪(Nicolet iS5,Thermo Fisher公司); NMR仪(AVANCE-Ⅲ600 MHz,BRUKER公司); 液相色谱-质谱联用(LC-MS)仪(Waters 2767,Waters公司); 荧光分光光度计(Cary Eclipse,Varian公司); 多功能酶标仪(M-450,BIO-RAD公司); 核酸蛋白分析仪(DU-800,Beckman公司).
1.3 方 法1.3.1 样品制备咖啡酸吗啉胺的制备方法如下:咖啡酸溶于二氯甲烷中,加入等浓度的2-氨乙基吗啉或N-氨丙基吗啉,以EDC·HCl作为脱水剂,DMAP作为催化剂,再加入N-甲基吗啉作为标准碱,于油浴中加热搅拌反应6~7 h; 反应结束后冷却至室温,旋转蒸发除去有机溶剂后得到黄色稠状液体,再通过凝胶柱层析纯化; 旋转蒸发后得到黄色粉末,烘干,待用.
1.3.2 酪氨酸酶活力测定按照文献[11]的方法稍作修改:在磷酸盐缓冲液(PBS,pH 6.8)中,以L-DOPA 为底物测定酪氨酸酶的活力.先加入0.1 mL含不同浓度的化合物于比色杯中,再加入2.8 mL在30 ℃恒温水浴中预热的底物溶液(含PBS和L-DOPA),然后加入0.1 mL酪氨酸酶水溶液,立刻充分混匀,在30 ℃恒温条件下检测波长475 nm处的吸光度随时间的变化,从直线的斜率计算出酶的活力,产物的消光系数按3 700 L/(mol·cm)计算.
1.3.3 全波长扫描采用酪氨酸酶二酚酶的测活体系[11],在含有0.5 mmol/L L-DOPA、1.33 μg/mL酪氨酸酶、0.05 mol/L PBS(pH 6.8)的反应体系中,采用DU-800型核酸蛋白分析仪,在200~800 nm光谱范围内,实时跟踪不同浓度的样品(C-1和C-2)作用下酪氨酸酶催化产物在相同时间后的变化,以及相同浓度的样品作用下酪氨酸酶催化产物在不同时间后的变化.
1.3.4 荧光猝灭采用Cary Eclipse荧光光度计测试酪氨酸酶内源荧光强度的变化,激发光波长设定为280 nm,发射光夹缝宽度为10 nm,检测波长范围为300~450 nm.在2 mL酪氨酸酶的体系中加入不同浓度的激活剂后,对荧光强度进行扫描.每个浓度重复3次实验.
荧光分子与猝灭剂间的猝灭速率都遵循Stern-Volmer曲线方程[12]:
F0/F=1+Kqτ0c(Q)=1+Ksvc(Q).
式中:F0和F分别是猝灭前、后的荧光强度,Kq是双分子的动态猝灭速率常数,τ0是不存在猝灭剂时的荧光生命周期(10-8 s),c(Q)是荧光猝灭剂浓度,Ksv是Stern-Volmer曲线的猝灭速率常数.根据Stern-Volmer曲线方程,以F0/F对所加入的化合物终浓度c(Q)作图,得到化合物对酪氨酸酶荧光的Stern-Volmer曲线,依此判断其荧光猝灭机制.
1.3.5 化合物对酪氨酸酶的分子对接模拟采用MOE软件(CCG公司)进行蛋白质-配体对接.在对接前,先将激活剂和酪氨酸酶的三维结构能量最小化.分子对接的参数如下:Receptor和Site分别设置为Receptor Atoms和Dummy Atoms,Refinement设置为Forcefield; Retain的第一和第二得分都设置为10,第一次和第二次Rescoring都设置为London dG; MM/GBVI绑定自由能得分用于排名对接; 其他参数使用软件的默认设置.在对接构象的过程中,选择得分最高的位点进行对接,再根据所选模式分析酶蛋白分子与化合物绑定后的对接结果.
1.3.6 细胞毒理试验细胞毒理通过噻唑蓝(MTT)试验测定[13].人体正常肝细胞LO2培养至密度为5×103/孔后,添加不同浓度的化合物与其孵育24和48 h; 然后在每孔中加入10 μL MTT溶液(用PBS配制,终质量浓度5 mg/mL),在37 ℃孵育4 h,弃上清液; 每孔加入150 μL 二甲基亚砜(DMSO)并震荡10 min,让紫色甲瓒完全溶解; 在570 nm下测定其吸光度.未加化合物处理时的吸光度作为细胞100%存活的标准.
1.3.7 细胞内酪氨酸酶活力测定人体黑色素瘤细胞M14内酪氨酸酶活力的测定根据文献[14]进行部分改进:收集细胞,1 500 r/min离心5 min后弃上清液,保留细胞沉淀; 在细胞沉淀中加入0.01 mol/L含有1%(体积分数)吐温-100的PBS,然后悬浮细胞冷冻于-80 ℃; 取出完全冻结的细胞,在室温下自然融化,反复冻融2次后,12 000 r/min 离心15 min得到的上层清液即为酪氨酸酶液; 在96孔板的各孔中加入10 μL不同浓度的化合物和10 μL细胞酪氨酸酶液,然后加入180 μL PBS配制的0.1%(质量分数)L-DOPA(pH 6.8),在30 ℃下孵育30 min,于475 nm处测定其吸光度.
1.3.8 细胞内蛋白表达量分析采用不同质量浓度(0,10,20,30,40 μg/mL)的化合物处理M14细胞,培养24 h后,经0.25%(质量分数)胰蛋白酶消化,收集细胞; 5 000 r/min离心取上清液,加入200 μL的RIPA(radio immunoprecipitation assay)裂解液,冰上裂解1 h; 10 000 r/min离心取上清液,测定蛋白浓度,分装,加入4×上样缓冲液,100 ℃热变性30 min; 所得样品进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(恒定电压90 V,110 min)后转膜(恒定电流300 mA,1 h),在4 ℃下孵育一抗过夜,用含1%(体积分数)吐温-20的Tris-盐酸缓冲液洗涤3次后,室温下孵育二抗1 h; 再洗涤3次后显影,分析相关蛋白的表达量.
- [1] FRIEDMAN M.Food browning and its prevention:an overview[J].J Agric Food Chem,1996,44(3):631-653.
- [2] 刘晓丹,黄磺,陈清西.苯甲酸对蘑菇酪氨酸酶抑制作用机理的研究 [J].厦门大学学报(自然科学版),2003,42(1):102-107.
- [3] DENG X Q,GONG S Z,ZHANG M Q.Caffeic acid activation of tyrosine enzyme catalytic reaction dynamics research [J].J Food Science,2008,29:98-101.
- [4] FANG D,KUTE T,SETALURI V.Regulation of tyrosinase-related protein-2(TYRP2)in human melanocytes:relationship to growth and morphology [J].Pigment Cell Res,2001,14:132-139.
- [5] NERYA O,VAYA J,MUSA R,et al.Glabrene and isoliquiritigenin as tyrosinase inhibitors from licorice roots [J].J Agr Food Chem,2003,51(5):1201-1207.
- [6] HEARING V J,TSUKAMOTO K.Enzymatic control of pigmentation in mammals [J].FASEB J,1991,5(14):2902-2909.
- [7] GRIMES P E,HAMZAVI I,LEBWOHL M,et al.The efficacy of afamelanotide and narrowband UV-B phototherapy for repigmentation of vitiligo [J].JAMA Dermatol,2013,149(1):68-73.
- [8] YE Y,CHOU G X,WANG H,et al.Flavonoids,apigenin and icariin exert potent melanogenic activities in murine B16 melanoma cells [J].Phytomedicine,2010,18(1):32-35.
- [9] MICHALUART P,MASFERRER J L,CAROTHERS A M,et al.Inhibitory effects of caffeic acid phenethyl ester on the activity and expression of cyclooxygenase-2 in human oral epithelial cells and in a rat model of inflammation [J].Cancer Res,1999,59(10):2347-2352.
- [10] TOLBA M F,OMAR H A,AZAB S S,et al.Caffeic acid phenethyl ester:a review of its antioxidant activity,protective effects against ischemia-reperfusion injury and drug adverse reactions [J].Crit Rev Food Sci Nutr,2016,56(13):1549-7852.
- [11] CHEN Q X,SONG K K,WANG Q,et al.Inhibitory effects on mushroom tyrosinase by some alkylbenzaldehydes [J].Journal of Enzyme Inhibition and Medicinal Chemistry,2003,18(6):491-496.
- [12] KIM Y J,UYAMA H.Tyrosinase inhibitors from natural and synthetic sources:structure,inhibition mechanism and perspective for the future [J].Cell Mol Life Sci,2005,62:1707-1723.
- [13] 邓轶韬,丁玉梅,李华亮,等.鳄胆素联合阿霉素对人肝癌细胞SMMC-7721的抑制作用 [J].厦门大学学报(自然科学版),2015,54(6):796-801.
- [14] CUI T T,YI X L,ZHANG W G,et al.miR-196a-2 rs11614913 polymorphism is associated with vitiligo by affecting heterodimeric molecular complexes of Tyr and Tyrp1 [J].Arch Dermatol Res,2015,307(8):683-692.